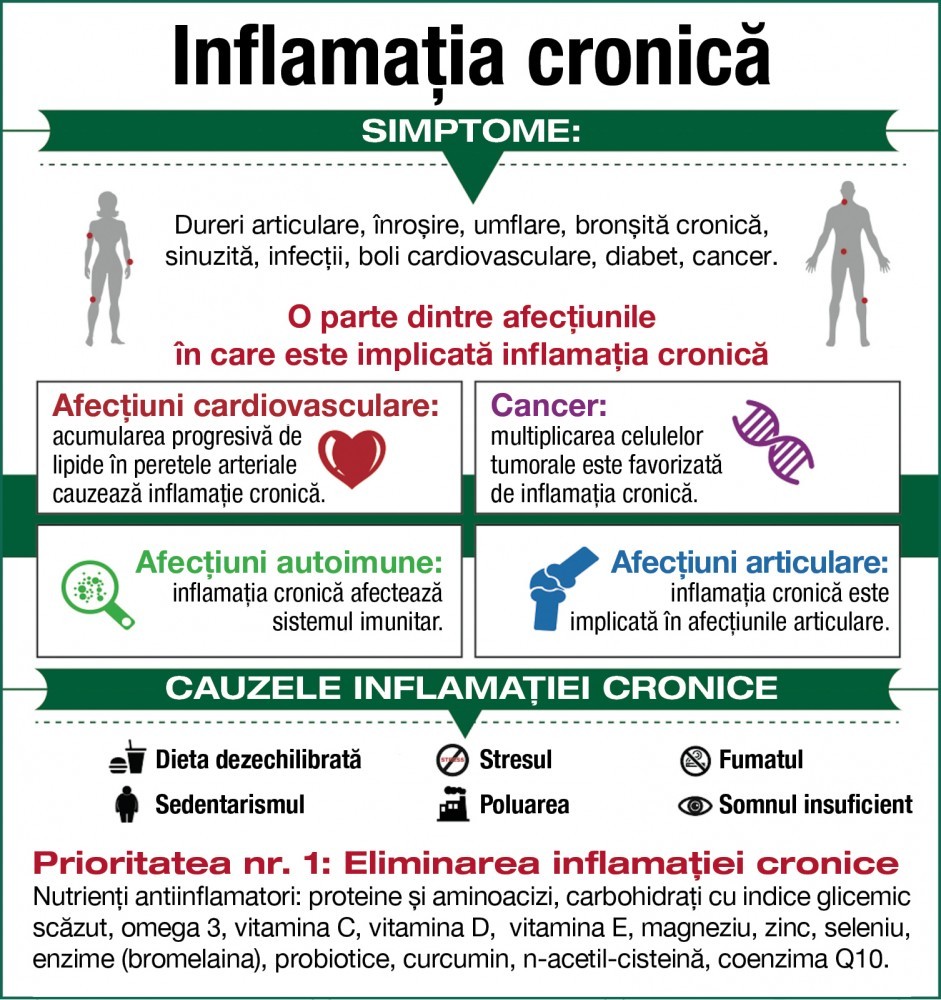
Inflamația este un concept destul de nou în medicină, „un câmp în curs de dezvoltare“, după cum susține Dr. David Heber, director fondator al UCLA Center for Human Nutrition. Inflamația cronică poate fi la originea a numeroase boli: de la boli de inimă la diabet, de la depresie la alergii sau chiar cancere.
Inflamația cronică și afecțiunile cardiovasculare
În prezent, este recunoscut faptul că ateroscleroza este o boală inflamatorie cronică, caracterizată prin acumularea progresivă, în peretele arterial, de lipide, celule inflamatorii şi rezidențe, proteine ale matricei extracelulare. LDL-ul infiltrat în căptuşeala arterelor coronare determină migrarea macrofagelor în încercarea de a curăța locurile blocate de colesterol, fapt care determină inflamația celulară cronică, care influențează major progresia şi activarea plăcilor de aterom, ruptura şi tromboza plăcilor active. Reacția inflamatorie este implicată în destabilizare prin subțierea capsulei plăcii de aterom şi creşterea riscului de ruptură a ei.
Inflamația cronică este parte integrantă a procesului de ateroscleroză (oxidarea lipoproteinei de joasă densitate – LDL colesterol stimulează răspunsul inflamator), prezența citokinelor pro-inflamatorii fiind asociată afecțiunilor arteriale periferice, insuficienței cardiace, fibrilației atriale, atacului cerebral şi afecțiunilor coronariene.
Numeroase dovezi experimentale, obținute prin studii epidemiologice, implică reacția inflamatorie şi imunologică în declanşarea şi evoluția aterosclerozei. Reacția inflamatorie este răspunsul sistemului imunitar la prezența LDL-ului oxidat sau a LDL-ului modificat enzimatic din cauza interacțiunii cu unele bacterii sau virusuri, cum ar fi: Chlamydia pneumoniae, Helicobater pylori şi virale (citomegalovirus, virus herpetic 1 şi 2, virus hepatitic A). În încercarea de a repara țesutul arterial lezat, sistemul imunitar concentrează în peretele arterial o serie de molecule (monocite, limfocite) cu rol în recunoaşterea şi fixarea colesterolului oxidat pe receptori specifici LOX. Depunerea excesivă a LDL determină, la rândul ei, un răspuns inflamator cronic, cu rol în apariția, progresia şi ruptura plăcii de aterom.
Coactivarea sistemului imunitar din cauza focarelor infecțioase cronice accelerează evoluția leziunilor ateromatoase.
Evoluția inflamației în ateromatoză este influențată de balanța dintre citokinele proinflamatorii – IL-6, IL-1, TNF-a şi IL-2 – şi citokinele antiinflamatorii – IL-10, TGF-b, secretate de macrofagele şi limfocitele T activate.
Inflamația prezentă în leziunile ateromatoase active este argumentată de prezența monocitelor activate în sinusul coronar şi a celulelor activate în sângele periferic – leucocite, neutrofile, monocite, trombocite. Prezența, semnificativ mai numeroasă, a limfocitelor T activate în plăcile instabile sugerează rolul reacției imun-inflamatorii în destabilizarea leziunilor ateromatoase, iar abundența macrofagelor activate susține rolul lor important în apariția ocluziei aterotrombotice. Celula endotelială activată devine disfuncțională şi începe să secrete substanțe pentru reparare (factori vasoconstrictivi, citokine proinflamatorii, factori de creştere pentru fibrele musculare netede vasculare şi factori protrombogeni). Endoteliul activat continuă şi amplifică reacția imunologică din placă. Disfuncția endotelială promovează reacția inflamatorie, spasm arteriolar, efecte protrombotice. Apoptoza celulelor endoteliale caracterizează leziunile aterosclerotice avansate.
La pacienții cu patologie cardiacă, reacția inflamatorie sistemică se exprimă şi prin creşterea nivelului seric al IL-6, proteinei C-reactive (CRP), amiloidului seric de tip A, neopterinei şi al fibrinogenului plasmatic. Creşterea nivelului seric al CRP este un marker pentru evoluția spre evenimente cardiovasculare majore.
Inflamația cronică și cancerul
Există studii care corelează legătura directă între inflamația cronică şi cancerul de prostată, ovarian, pancreatic, colorectal, de plămâni şi limfom. Există mai multe mecanisme prin care inflamația cronică poate contribui la formarea şi înmulțirea celulelor canceroase, cum ar fi alterarea expresiei genice, mutații ale ADN-ului, alterări epigenice, vascularizarea tumorii.
În anii 1860, patologul Rudolf Virchow susținea că tumorile canceroase apar în locurile unde se află inflamații cronice. Un secol mai târziu, oncologii au început să acorde mai multă atenție mutațiilor genetice care joacă un rol important în promovarea formațiunilor anormale care eventual pot deveni maligne. Acum, cercetătorii analizează dacă nu cumva mutațiile şi inflamațiile controlează reciproc nişte procese care, neverificate, pot transforma celulele normale în unele mutante ce duc la formarea tumorilor.
Inflamația cronică și diabetul
Deşi cercetătorii au descoperit că există o interacțiune complexă între inflamație, insulină şi grăsime, mecanismul nu este pe deplin elucidat. S-a constatat însă că infiltrarea macrofagelor în țesutul gras şi eliberarea citokinelor proinflamatorii în circulație este un fenomen des întâlnit la diabeticii de tip II şi este ştiut faptul că citokinele proinflamatorii descresc sensibilitatea la insulină. Un studiu a asociat hiperglicemia acută cu creşterea semnificativă a citokinelor proinflamatorii, mai ales la indivizii cu toleranță modificată la glucoză.
Inflamația cronică și degenerescență maculară
Evaluările efectuate pe 11 populații depăşind 41.000 de persoane au demonstrat o asociere clară între creşterea nivelului CPR (proteină C-reactivă) peste 3mg/L şi incidența degenerescenței maculare. Riscul acestor populații de dezvoltare a degenerescenței maculare legate de vârstă este de 2 ori mai mare decât al persoanelor cu CPR 1mg/L.
Inflamația cronică și afecțiunile renale
Inflamația cronică a rinichilor poate conduce la reținerea mai multor molecule proinflamatorii în sânge (inclusiv citokine, produşi de glicozilare avansată şi homocisteină). Excreția redusă a substanțelor proinflamatorii, determinată de disfuncționalitatea renală, poate accelera progresia inflamației cronice şi în alte părți ale corpului, cum ar fi sistemul cardiovascular. Prin rinichii bolnavi se poate accelera progresia tulburărilor inflamatorii cronice în altă parte a corpului, cum ar fi sistemul cardiovascular.
Inflamația cronică și osteoporoza
Citokinele inflamatorii (TNF-α, IL-1β, IL-6) sunt implicate în metabolismul normal al osului. Osteoclastele sunt celulele (un tip de macrofage) care distrug țesutul osos. Creşterea constantă a citokinelor proinflamatorii (fenomen caracteristic menopauzei) stimulează resorbția osoasă. Sunt stabilite corelații între pierderea de masă osoasă şi afecțiunile periodontale, pancreatite, afecțiuni inflamatorii ale colonului şi artrite reumatoide.
Inflamația cronică și declinul cognitiv
Câteva studii observaționale au stabilit legătura între inflamația cronică la bătrâni şi scăderea funcțiilor cognitive, demență vasculară şi Alzheimer. Un studiu a a concluzionat că persoanele cu valori mari ale CRP şi niveluri ale IL-6 ; 2,4 pg/mL au un risc crescut de declin cognitiv.
Studiile recente au demonstrat existența unei corelații între producerea inflamației neurologice (determinate de mediatorii inflamatori produşi în cascadă) şi autism, ADD / ADHD şi Alzheimer.
Care sunt markerii şi mediatorii inflamației
Factorul de necroză tumorală (TNF-α) este o citokină (proteină) cu rol de semnalizare intercelulară (la distanțe mari) care este eliberată de celulele imune ca răspuns la stres celular, degradări celulare sau infecții. Împreună cu alți mediatori ai inflamației, încetineşte dezvoltarea patogenilor, activează efectul bactericid al neutrofilelor şi este necesară pentru înmulțirea unor celule ale sistemului imunitar. Nivelul ridicat determină inflamația cronică, creşte tromboza (coagularea sângelui), descreşte contractibilitatea cardiacă şi poate fi implicat în apariția şi dezvoltarea tumorilor.
Factorul nuclear kappa-B (NF-kB) inițiază răspunsul inflamator. Când celulele sunt expuse semnalelor de distrucție (din cauza stresului oxidativ sau a valorilor mari ale TNF-alfa), ele activează NF-kB, care creşte expresia a peste 400 de gene implicate în răspunsul inflamator. Aceasta include o serie de citokine şi enzime proinflamatorii (cyclooxygenaza-2 COX-2 şi lipoxygenaza).
Interleukinele sunt cytokine cu funcții în inducerea şi stoparea inflamației. Interleukinele proinflamatorii IL-1β ajută celulele sistemului imunitar să treacă din sânge în țesuturile disfuncționale sau distruse; IL-6 are rol proinflamator şi antiinflamator şi coordonează producția substanțelor care stopează inflamația acută; IL-8 este expresia atât a celulelor imune, cât şi a celor nonimune şi ajută la atragerea neutrofilelor în locurile afectate.
Proteina C reactivă (C-reactive protein – CRP) este o proteină produsă în ficat ca urmare a răspunsului inflamator. Scopul principal este de a acoperi celulele afectate pentru a permite identificarea lor mai uşoară de către celulele sistemului imunitar. Nivelurile uşor crescute ale proteinei C-reactive nu pot diagnostica selectiv afecțiunile în care apar (afecțiuni cardiovasculare şi gastrointestinale, cancere, reumatism), dar valorile crescute ale proteinei C înalt sensibile sunt corelate cu riscul crescut de afecțiuni cardiovasculare şi accident cerebral.
Eicosanoidele sunt mesageri locali produşi de celulele din vecinătatea focarului inflamator. Dintre acestea, prostaglandinele au rol în inflamație şi în antiinflamație, în creşterea celulei, precum şi în construcția şi dilatarea vaselor de sânge. Tromboxanii sunt mediatori ai proceselor de coagulare, iar leucotrienele proinflamatorii au un rol important în atragerea şi activarea celulelor albe în timpul inflamației. Eicosanoidele cele mai puternice inflamatorii sunt produse din acizi graşi omega-6 (acidul linoleic şi arahidonic).
Omega 3 și reducerea inflamației
Dietele bogate în acizi graşi omega-3 sunt asociate cu producția de eicosanide puțin inflamatorii sau antiinflamatorii, acestea determinând un grad redus de inflamație şi implicit risc cardiovascular redus.
Ciclooxigenazele şi lipoxigenazele
Ciclooxigenazele (COX) şi lipoxigenazele (LOX) sunt enzime care catalizează sinteza eicosanoidelor din acizii graşi.
Ciclooxigenazele inițiază obținerea multor prostaglandine şi tromboxani din derivații de acizi graşi omega-3 şi omega-6. Inhibarea acestora duce la scăderea sintezei de prostaglandine şi, prin urmare, o reducere a inflamației, febrei şi a durerii.
Există două enzime COX cu roluri distincte. COX-2 are rolul cel mai important în procesele inflamatorii, deoarece stimulează procesul inflamator prin producerea prostaglandinelor şi tromboxanilor.
Lipoxigenazele transformă acizii graşi în leukotriene proinflamatorii, care sunt mediatori locali importanți în inflamație. Unele leukotriene produse de lipoxigenaza 5 (5-LOX) au rolul de a strânge celulele albe la locul inflamației şi de a stimula celulele locale să producă cytokine, care amplifică răspunsul inflamator.
Deşi enzimele COX şi LOX sunt adesea asociate procesului inflamator, ele au şi rolul de a produce factori care să inhibe şi să oprească procesul inflamator și să inițieze repararea țesuturilor lezate (prostaciclinele şi lipoxinele).
Trecerea corectă din activitatea proinflamatorie în cea antiinflamatorie este mecanismul care determină evoluția unui răspuns inflamator normal.
Teste sanguine care evidențiază inflamația
Pentru inflamația acută: numărul de leucocite, viteza de sedimentare a hematiilor (VSH), electroforeza proteinelor.
Pentru inflamația cronică:
- Markerii nespecifici pentru inflamația cronică sunt:
- Proteina C reactivă înalt sensibilă (High-sensitivity C-reactive protein) – Interval optim: la bărbați sub 0,55 mg/L; la femei <1,0mg/L;
- Fibrinogen – Interval optim 200-300 mg/dL.
Markerii specifici pentru inflamația cronică sunt:
- Factorul de necroză tumorală (TNFα) – Valori normale <8,1 pg/mL;
- Interleukină-1 beta (IL-1β) – Valori normale <15,0 pg/mL;
- Interleukină-6 (IL-6) – Valori normale 2-29 pg/mL;
- Interleukină-8 (IL-8) – Valori normale <32,9 pg/mL.
Markeri suplimentari: glucoză în sânge, hormonii sexuali, vitamina D (25-hydroxivitamina D).
Cum putem evita sau reduce inflamația cronică?
Strategia pe termen lung pentru eliminarea inflamației cronice este asigurarea suportului necesar pentru a menține funcții biologice normale.
Alimentația sănătoasă şi corectă, neprocesata, non-toxică, joacă un rol determinant. O alimentație greşită (chiar dacă este „curată“, bio) poate deveni automat un stresor major pentru organism, dacă nu corespunde cerințelor unice genetice şi biochimice ale acestuia.
Este esențială eliminarea alimentelor inflamatorii (prăjeli, zaharuri, alimente procesate, uleiurile vegetale săturate şi trans-esterificate, cum ar fi margarinele, alimente reactive, cum pot fi glutenul şi lactatele, aditivi şi alte substanțe toxice, industriale etc.).
- Surse:
- lifeextension.com/protocols/health-concerns/chronic-inflammation/page-01
- marksdailyapple.com/top-6-anti-inflammatory-foods/
- marksdailyapple.com/how-to-tell-if-youre-inflamed-objective-and-subjective-inflammatory-markers/
- cardiovascres.oxfordjournals.org/content/63/4/582
- discoverymedicine.com/Nancy-S-Jenny/2012/06/25/inflammation-în-aging-cause-effect-or-both/
- examine.com/supplements/harpagophytum-procumbens/
- examine.com/supplements/boswellia-serrata/