Anul 2024, Anul Sănătății Metabolice la Zenyth!
Toate celulele din corp prezintă receptori de insulină, dar țesutul muscular și adipos sunt cele mai impactate de rezistența la insulină.
Efectele insulinei, deficitului de insulină și rezistenței la insulină variază în funcție de rolul fiziologic al țesuturilor și organelor în cauză și de dependența acestora de insulină pentru procesele metabolice.
La nivelul ficatului și țesutului muscular, insulino-rezistența se va traduce printr-o creștere a glucozei în sânge, iar la nivelul țesutului adipos printr-o creștere a acizilor grași.
Ultimul webinar al anului din seria Zenyth Better Medicine a aprofundat subiectele discutate în întâlnirile anterioare, concentrându-se pe rezistența la insulină specifică țesuturilor. Dr. Camelia Ober, medic primar cardiolog la Institutul Inimii din Cluj-Napoca, a detaliat rolul alimentației personalizate în gestionarea obezității.
Efectele rezistenței la insulină la nivelul țesuturilor
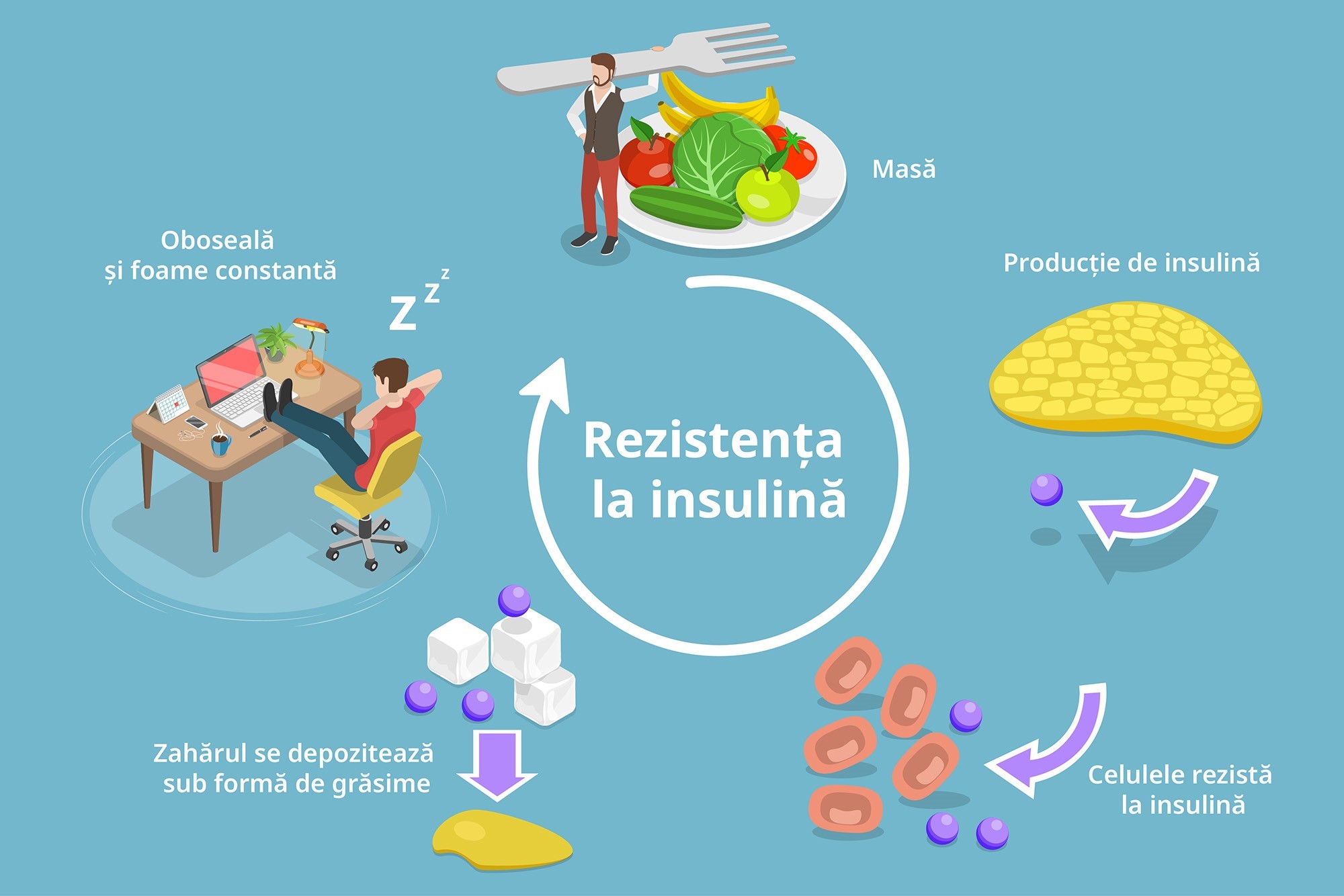
Rezistența la insulină poate apărea în diverse țesuturi, precum ficatul, mușchii scheletici sau țesutul adipos, iar perturbarea semnalizării în aceste zone generează multiple efecte cardiometabolice
Este important de reținut că cea mai mare parte (60-70% ) din insulina produsă de pancreas ajunge la nivelul ficatului și aproximativ 30-40% ajunge la nivelul țesuturilor periferice. De aceea primele țesuturi afectate sunt ficatul sau/și mușchii. Țesutul adipos își păstrează sensibilitatea la insulină chiar și atunci când rezistența la insulină la nivelul ficatului sau mușchilor este extrem de exprimată. Și atunci, în timp ce ficatul produce în continuare glucoză (cu toate că există glucoză în sânge și la nivelul mușchiului nu se poate capta glucoza, deși mușchiul ar avea nevoie), țesutul adipos captează glucoza sub influența insulinei care este în cantitate mare în circulație și va duce la creșterea sintezei de lipide, care, în final, se va transforma în depozit de grăsime.
Țesutul adipos și obezitatea
Țesutul adipos este cel mai sensibil țesut la insulină. Acesta face depozite indiferent de cererea de energie, fie crescând numărul de celule, fie crescând volumul celulelor.
Când capacitatea țesutului adipos de a stoca excesul energetic sub formă de lipide sau de glucoză este depășită, acest proces are loc în alte țesuturi și va duce la apariția unor condiții patologice foarte frecvent întâlnite, și anume: steatoza hepatică, afectarea grăsoasă a pancreasului cu impactarea funcției acestuia, creșterea grăsimii viscerale care este puternic pro-inflamatorie și creșterea procentului de țesut adipos în detrimentul țesutului muscular.
Așadar, obezitatea nu este o condiție simplă care se datorează doar unui exces energetic, ci este rezultatul interacțiunii multor factori hormonali, metabolici și neuronali.
De aceea este necesar ca intervenția asupra obezității să se facă pe toate planurile și nu doar prin gestionarea greutății.
Multe complicații asociate obezității necesită o pierdere în greutate de peste 10% pentru a aduce beneficii clinice semnificative. Deși pierderi de 20-30% pot fi obținute prin tratamente chirurgicale sau farmacologice, intervențiile intensive de schimbare a stilului de viață generează, de obicei, pierderi de 5-10%.
Pentru o scădere în greutate de succes este important să înțelegem modul de modulare a poftei de mâncare și studiile au arătat că nu neapărat creșterea glucozei după masă este importantă, cât mai ales gradul de scădere a glucozei la 2-3 ore după masă. Mai exact, cu cât mai însemnată este scăderea glucozei la 2-3 ore după masă, cu atât mai crescută va fi senzația de foame și cu atât mai bogată din punct de vedere energetic va fi următoarea masă. Acest parametru poate să fie un indicator al faptului că dieta urmată nu este una potrivită pentru acea persoană.
Dar sațietatea postprandială este influențată de o serie de evenimente fiziologice după masă, inclusiv distensia gastrică, eliberarea de peptide gastrointestinale și metaboliți plasmatici, printre care cea mai proeminentă este glucoza plasmatică, modulată de insulină, care a fost mult timp considerată ca fiind unul dintre cei mai importanți markeri ai sațietății postprandiale.
Un alt organ cu un impact important asupra procesului de sațietate este creierul. Există 3 mecanisme neuroendocrine din nucleul limbic al creierului care:
- previn înfometarea (hipotalamusul ventromedial).
- cresc recompensa (zona tegmentală ventral și nucleul accumbens).
- atenuează stresul (amigdala).
Aceste 3 zone ale creierului conlucrează în menținerea unui status energetic corespunzător la nivelul triunghiului limbic pe care îl realizează. Indiferent ce vârf al triunghiului este afectat, va avea aceleași consecințe și anume va duce la creșterea consumului de hrană, rezultând o creștere persistentă în greutate.
Insulina și leptina, doi hormoni de care trebuie să știi!
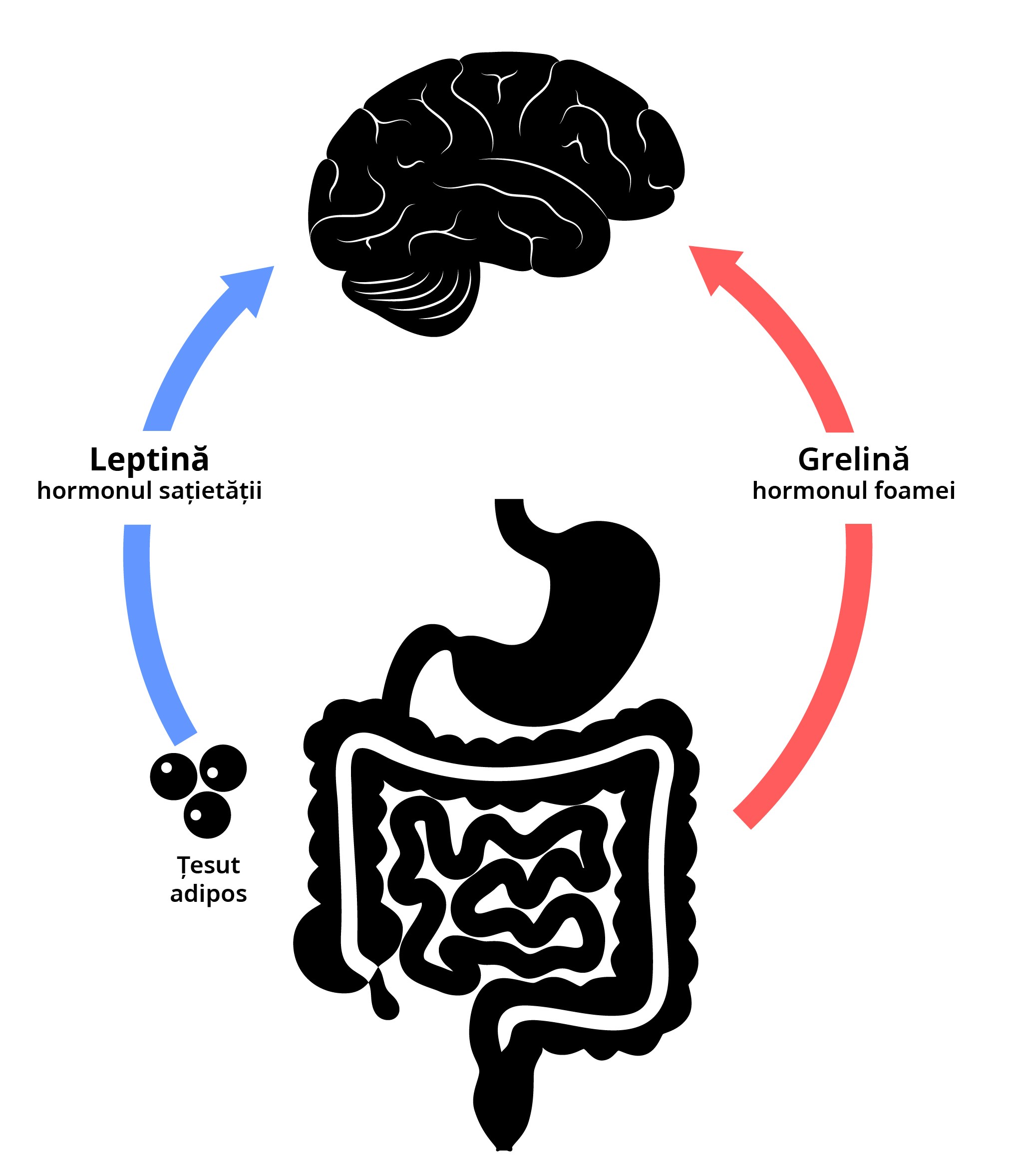
Atât insulina, cât și leptina sunt hormoni cu un rol important la nivelul sistemului nervos central în gestionarea senzației de foame, în reglarea apetitului și a multor altor procese.
Ambii hormoni sunt secretați în perioadele de suficiență energetică sau de exces, iar receptorii lor se co-localizează la aceiași neuroni din hipotalamusul ventromedial.
Asemănările lor de acțiune sugerează că acţionează ca barometre duale de depozite de energie.
Nivelurile de insulină reflectă modificări pe termen scurt ale aportului de energie, în timp ce nivelurile de leptină reflectă echilibrul energetic pe o perioadă mai lungă de timp.
Cel mai important de reținut este faptul că hiperinsulinemia previne semnalizarea leptinei, promovând „răspunsul de foame”, care duce la consum de alimente în exces.
Creșterea în greutate este determinată de starea hiperinsulinemică, prin trei mecanisme:
- Împărțirea energiei în țesutul adipos.
- Interferența cu transducția semnalului leptinei.
- Creșterea plăcerii consumului de alimente.
De aceea, pentru a preveni obezitatea, este foarte important să îmbunătățim sensibilitatea la insulină.
Cum ne dăm seama ce țesut este afectat de insulino-rezistență?
Glucoza bazală (de dimineață) crescută se referă la insulino-rezistență la nivel hepatic, iar glucoza în sânge crescută la 60 min sau la 2 ore după o încărcare cu glucoză reflectă insulino-rezistență la nivel muscular. Din păcate, de cele mai multe ori, cele două coexistă.
Toate tipurile de insulino-rezistență (hepatică, musculară, dar și la nivel de țesut adipos) sunt asociate cu niveluri ridicate de trigliceride circulante, sugerând că nivelurile ridicate de trigliceride sunt mai probabil o oglindă a rezistenței la insulină a întregului corp.
De asemenea, ambele tipuri de insulino-rezistență (hepatică și musculară) cresc riscul de diabet de tip 2 și sunt numite în mod colectiv „prediabet”.
Persoanele care prezintă o toleranță scăzută la glucoză au un risc mai mare de dezvoltare a retinopatiei diabetice decât persoanele care prezintă doar glicemia bazală modificată.
Subiecții cu glicemie bazală modificată, care manifestă predominant rezistență hepatică la insulină pot vedea îmbunătățiri atunci când folosesc metformin sau berberină.
Subiecții cu toleranță scăzută la glucoză, care au predominant rezistență musculară la insulină combinată cu secreție severă de insulină, sunt mai predispuși să răspundă la tratamente care îmbunătățesc rezistența la insulină a mușchilor scheletici.
Pe lângă glicemia la 30 minute, ar fi bine să măsurăm și insulina (insulina-30) deoarece secreția de insulină este, de multe ori, disproporționată raportat la cantitatea de glucide pe care o administrăm, iar acest răspuns exagerat la insulină se va traduce printr-o tendiță de creștere în greutate.
S-a constatat că pierderea în greutate este cu aproximativ 4 kg mai mare în rândul participanților cu o valoare ridicată a insulinei-30 atunci când au consumat o dietă cu încărcătură glicemică scăzută, comparativ cu o dietă cu încărcare glicemică ridicată.
Dietele și sensibilitatea la insulină

Dietele bogate în proteine de calitate și în fibre au un impact pozitiv, atât asupra rezistenței la insulină hepatice, cât și asupra celei musculare, iar dieta mediteraneană s-a dovedit a fi cea mai benefică prin faptul că determină scăderea conținutului de grăsime la nivelul ficatului, îmbunătățind insulino-rezistența la acest nivel.
Calitatea grăsimilor consumate este foarte importantă, deoarece poate afecta în mod specific metabolismul lipidelor din mușchii scheletici și sensibilitatea periferică la insulină.
Îmbunătățirile sănătății cardiometabolice după modularea compoziției macronutrienților din dietă depind de fenotipul rezistenței la insulină specific țesuturilor.
S-a dovedit că persoanele cu insulino-rezistență predominant musculară au răspuns mai bine la o dietă bogată în acizi grași monosaturați, în timp ce persoanele cu insulino-rezistență predominant hepatică au răspuns mai bine la o dietă cu conținut scăzut de grăsimi și carbohidrați complecși.
Persoanele normoglicemice, prediabetice și diabetice pot răspunde diferit la diferite diete:
- Persoanele normoglicemice (glicemia a jeun <100 mg/dL) cu exces de greutate și obezitate par să reacționeze cel mai bine la dietele cu conținut scăzut de grăsimi și carbohidrați.
- Persoanele normoglicemice cu o glicemia a jeun între 90 și 100 mg/dL pot vedea îmbunătățiri și prin creșterea aportului de fibre.
- Persoanele prediabetice (glicemia a jeun =100–125 mg/dL) beneficiază cel mai mult de creșterea cantității de fibre consumate și reducerea încărcăturii glicemice.
- Persoanele prediabetice cu o glicemia a jeun între 115 și 125 mg/dL pot beneficia de creșterea cantității de grăsimi din dieta lor în detrimentul carbohidraților totali.
- Persoanele diabetice cu glicemia a jeun ≥ 126 mg/dL (în multe cazuri persoanele cu DZT2) ar trebui să se concentreze nu numai pe calitatea carbohidraților consumați, ci și pe reducerea totală a carbohidraților și creșterea aportului de grăsimi din dietă.
Valorile insulinei-30 par a fi cea mai bună măsură a insulinemiei pentru prezicerea răspunsului la o dietă, iar utilizarea combinată a valorilor glicemiei bazale și a insulinei bazale pare să fie foarte promițătoare ca un predictor al pierderii în greutate și al menținerii pierderii în greutate pentru diferite diete.
Adăugarea valorilor insulinei bazale ca un marker al succesului scăderii în greutate pe diferite diete pare a fi deosebit de importantă pentru cei din subgrupul normoglicemic, deoarece pierderea în greutate și menținerea acesteia la indivizii cu glicemie bazală scăzută și valori ridicate ale insulinei bazale par să fie mai puțin influențate de compoziția specifică a dietei (adică acest subgrup nu răspunde diferit la intervențiile dietetice).
Exercițiul fizic și rezistența la insulină
Sedentarismul este asociat cu rate mai mari de mortalitate și morbiditate. La persoanele cu diabet sau pe punctul de a dezvolta diabet, sedentarismul prelungit este, de asemenea, asociat cu un control glicemic mai slab.
Sedentarismul întrerupt de ridicat în picioare și de mișcare de scurtă durată (aproximativ 5 minute) sau de mișcare de intensitate ușoară la fiecare 20-30 de minute îmbunătățește controlul glicemic la populațiile sedentare supraponderale/obeze și la femeile cu reglarea deficitară a glucozei.
La adulții cu diabet zaharat de tip 2, întreruperea șederii prelungite cu 15 minute de mers după masă și cu 3 minute de activități simple de rezistență cu greutatea corporală la fiecare 30 de minute îmbunătățește controlul glicemic.
Antrenamentul aerobic regulat crește sensibilitatea musculară la insulină la persoanele cu prediabet și diabet de tip 2, proporțional cu volumul exercițiului.
Chiar și antrenamentul cu volum redus (cheltuind doar 400 kcal/săptămână) îmbunătățește acțiunea insulinei la adulții anterior sedentari, iar la cei cu rezistență mai mare la insulină, cele mai mari îmbunătățiri se observă la cheltuieli calorice de 2500 kcal/săptămână.
Concluzii
Rezistența la insulină este controlată prin mecanisme de semnalizare intracelulară și poate fi indusă de multe condiții și stimuli, printre care stres oxidativ, glucocorticoizi (stres), inflamație și hiperinsulinemie.
Rezistența la insulină este o afecțiune fiziopatologică maleabilă, cu mai multe ținte centrale și periferice, iar intervenția se poate face înainte să se ajungă la excitație ireversibilă sau la toxicitate inflamatorie.